أصبح مفهوم الذرة في عصرنا الحالي أمرًا مسلّمًا به، ولكن منذ عصور خلت لم يؤمن أحد بوجود الذرة، فقد طرح فيلسوف يوناني يدعى Leucippus وتلميذه Demokritos الفكرة قبل 2500 عام، حيث اعتبرا أن الكون مؤلف من جسيمات صغيرة غير قابلة للتجزئة أطلقا عليها اسم الذرات، إلا أن الفيلسوف اليوناني الشهير أرسطو لم يتفق معهما، ونظرًا لكون نظرياته محل ثقة في أوروبا لما يقرب 2000 عام فقد تأجلت فكرة الذرات لقرون لاحقة.
ما هي الذرة؟ وما المقصود بالعدد الذري والعدد الكتلي للعناصر الكيميائية؟ وكيف يمكننا حساب كل منهما؟ جمعنا لكم معلومات وافية عن هذا الموضوع فيما يلي.
مفهوم الذرة
الذرة هي الوحدة الأساسية لبناء المادة، تساعدنا في تحديد هوية العناصر المختلفة، وتحتفظ بجميع خصائصها الكيميائية، ولا يمكن تقسيمها إلى وحدة أصغر مع الاحتفاظ بهذه الخصائص التي تحصل عليها من الجسيمات دون الذرية الدقيقة جدًا التي تتكون منها والتي تسمى البروتونات والنيوترونات والإلكترونات، وتعرف هذه الجسيمات بأجزاء الذرة، ومن المعروف أنها تتواجد في الذرات على اختلاف أنواعها باستثناء الشكل الشائع للهيدروجين. يمكن حساب عدد هذه الجسيمات دون الذرية في الذرة من العدد الذري والعدد الكتلي للذرة.
تقسم الذرة في تركيبها إلى منطقتين هما: النواة الذرية الصغيرة، وتقع في وسط الذرة وتحتوي على جسيمات موجبة الشحنة تسمى البروتونات، وجسيمات محايدة غير مشحونة تسمى النيوترونات. إذن لا تحتوي البروتونات والنيوترونات على نفس الشحنة، إلا أن لها نفس الكتلة تقريبًا.
أما المنطقة الثانية، وهي الجزء الأكبر بكثير من نواة الذرة، فتتكون من سحابة من الإلكترونات، وهي جسيمات سالبة الشحنة، عديمة الكتلة نسبيًا، تدور حول النواة، وتعد قوة التجاذب الهائلة بين هاتين المنطقتين هي السر في تماسك الذرة وتفسر بالتالي صلابة المواد في الطبيعة.
مفاهيم مكونات الذرة الأساسية
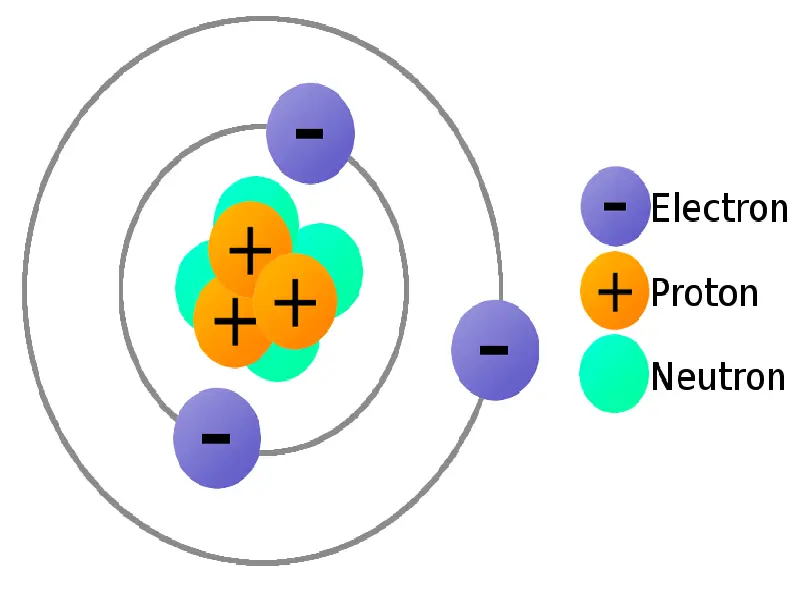
عرفنا سابقًا أن الذرة مكونة من مجموعة جسيمات تحمل شحن إما موجبة أو سالبة أو حتى محايدة، هي البروتونات، الإلكترونات والنيوترونات على التسلسل، حيث تحتوي الذرة على أعداد متساوية من البروتونات والإلكترونات. ونظرًا لأن البروتونات والإلكترونات لها شحنة متساوية ومتعاكسة بالإشارة، مما يعني أن الذرات محايدة كهربائيًا بشكل عام. وهذه الجسيمات كالتالي:
1 – البروتونات:
البروتونات عبارة عن جسيمات دون ذرية موجبة الشحنة، توجد في نواة جميع الذرات. شحنة البروتون هي +1. العدد الذري لعنصر ما يساوي عدد البروتونات في نواته. تقاس كتلة البروتونات بالـ amu (وحدات الكتلة الذرية).
2 – النيوترونات:
النيوترونات عبارة عن جسيمات دون ذرية شحنتها محايدة، توجد في نواة جميع الذرات باستثناء الهيدروجين. كتلة النيوترون أكبر بقليل من كتلة البروتون. يمكن أن يتحول النيوترون إلى بروتون وإلكترون ومضاد نيوترينو. تسمى كل من البروتونات والنيوترونات بالنيوكليونات nucleons.
تعتبر النيوترونات مهمة لأنها تحدد نظير العنصر. على سبيل المثال، الكربون الذي يحتوي على 6 نيوترونات هو الكربون -12، ولكنه يضيف نيوترونين آخرين وتحصل على الكربون -14، والذي يستخدم وجوده في المواد العضوية في التأريخ بالكربون المشع، ويعرف أيضًا باسم التأريخ بالكربون -14.
3- الإلكترونات:
الإلكترونات هي الجسيمات دون الذرية التي تدور حول نواة الذرة توجد في أغلفة الإلكترونات المحيطة بالنواة، وهي سالبة الشحنة وأصغر بكثير من البروتونات أو النيوترونات بـحوالي 1800 مرة. شحنة الإلكترون هي (-1).
4 – النواة:
هي المنطقة الواقعة في مركز الذرة، وتحتوي على كل من البروتونات والنيوترونات.
5 – قذائف الإلكترون:
المنطقة الواقعة على المنطقة الخارجية للذرة وتحتوي على إلكترونات فقط.
المادة والعنصر
العناصر هي المكونات الأساسية للمادة لها خصائص كيميائية وفيزيائية محددة ترتبط مع بعضها البعض بروابط كيمائية، ولا يمكن تقسيمها إلى مواد أخرى، من خلال تفاعلات كيميائية عادية، كالذهب والكربون. في الطبيعة 92 عنصرًا تتواجد بشكل طبيعي، أما بقية العناصر التي يبلغ عددها 26 عنصرًا فيتم صنعها في المختبرات وهي غير مستقرة.
يتم تحديد كل عنصر برمزه الكيميائي، وهو حرف واحد كبير أو مزيج من حرفين حسب الرموز الكيميائية للعناصر الأخرى المأخوذة من أسمائها اللاتينية. مثل رمز الصوديوم هوNa ، وهو شكل قصير منnatrium ، الكلمة اللاتينية للصوديوم.
تشكل العناصر الأربعة المشتركة لجميع الكائنات الحية وهي الأكسجين (O) والكربون (C) والهيدروجين (H) والنيتروجين (N)حوالي 96 ٪ من جسم الإنسان. أما في العالم غير الحي، فتوجد العناصر بنسب مختلفة. تخضع جميع العناصر والتفاعلات الكيميائية فيما بينها لنفس القوانين الكيميائية والفيزيائية، بغض النظر عما إذا كانت جزءًا من العالم الحي أو غير الحي.
العدد الذري للعناصر الكيميائية (Z)
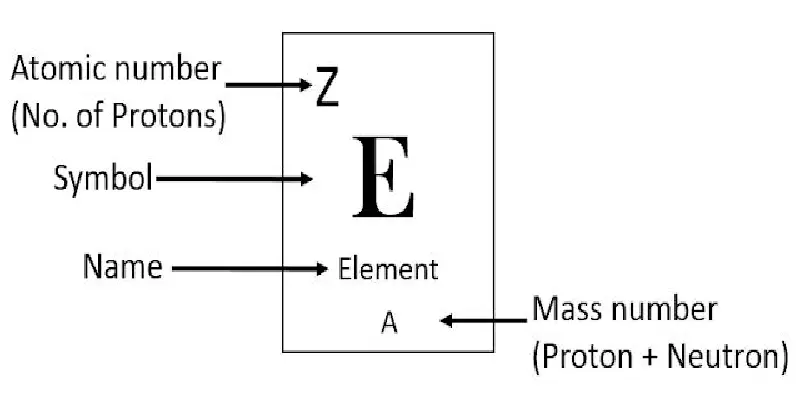
بعد تعرفنا على المادة والعناصر والمفهوم العام للذرة لا بد من التعرف على مفهوم العدد الذري (Aotmic number)، فالعدد الذري لأي عنصر كيميائي هو عدد البروتونات (الشحنات الموجبة) الموجودة في نواة الذرة وهو يحدد هوية العنصر، ويرمز له بالرمز Z.
يحدد العدد الذري الخصائص الكيميائية للعنصر وذلك لأن عدد البروتونات يساوي عدد الإلكترونات في الذرة المحايدة كهربائيًا. وهذا بدوره يحدد التكوين الإلكتروني للذرة وطبيعة غلافها الخارجي أو غلاف التكافؤن الذي يلعب دورًا أساسيًا في تكوين الذرة للروابط الكيميائية والمشاركة في التفاعلات الكيميائية.
لتوضيح مفهوم العدد الذري في الجدول الدوري الحديث، الذي اكتشفه العالم هنري موزلي بالإعتماد على جدول مندلييف، يتم ترتيب العناصر تبعًا لزيادة العدد الذري، حيث يوضع العدد الذري أعلى العنصر في الجدول الدوري، ويُعبر عنه برقم صغير رمزه Z يوضع أسفل يسار العنصر عند التعبير عنه. فمثلًا العدد الذري للهيدروجين هو 1، العدد الذري للكربون هو 6 ، والعدد الذري للفضة هو 47 ،هذا يعني أن أي ذرة بها 47 بروتونًا هي ذرة من الفضة. ما سبق يفضي إلى القاعدة التالية: يؤدي تغيير عدد النيوترونات في عنصر ما إلى تغيير نظائره، بينما يؤدي تغيير عدد الإلكترونات إلى جعله أيونًا.
العدد الكتلي للعناصر الكيميائية (A)
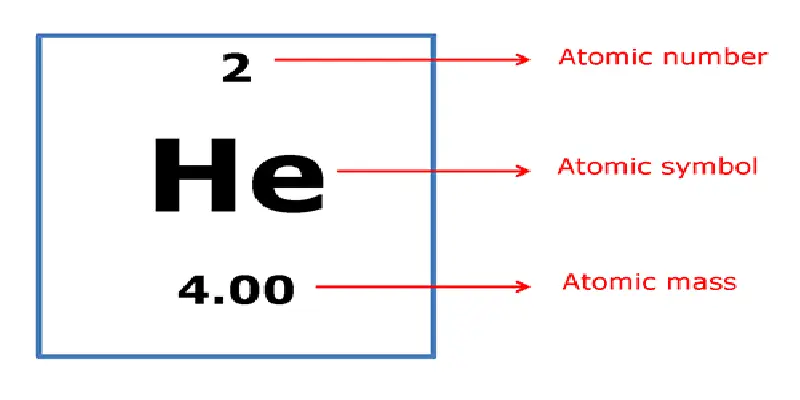
العدد الكتلي للذرة (Atomic mass) هو العدد الإجمالي لمجموع البروتونات والنيوترونات الموجودة في نواة هذه الذرة. ويعبر عنه كمايلي:
العدد الكتلي = عدد البروتونات + عدد النيوترونات
وكمثال على ذلك يحتوي النيتروجين على سبع بروتونات في نواته وسبعة نيوترونات، مما يجعل عدده الكتلي = 14.
ويعد النظر في الجدول الدوري أسهل طريقة لإيجاد الكتلة الذرية لعنصر ما، على الرغم من أن ذرات العناصر المختلفة تحتوي على أعداد كتلية مختلفة، إلا أنه يمكن أن تتشابه وكمثال على ذلك العدد الكتلي لذرات الأرجون والكالسيوم والذي يعادل = 40.
فالعدد الكتلي في النواة هو العدد المركب للبروتونات والنيوترونات، لذا فهو عدد البروتونات والنيوترونات، ويرمز الحرف A إليه. إذن، A هو العدد الكتلي، الذي يساوي عدد البروتونات، أي العدد الذري الذي نرمز إليه بواسطة Z، مضافًا إليه عدد النيوترونات.
الجدول الدوري لبعض العناصر الكيميائية
أمثلة عن حساب العدد الذري والعدد الكتلي لبعض العناصر الكيميائية
يكون عادةً العدد الذري والعدد الكتلي للعناصر عددًا صحيحًا، حيث أنها تمثل (البروتونات والنيوترونات والإلكترونات). مجموع العدد الكتلي والعدد الذري للذرة (A-Z) يتوافق مع العدد الإجمالي للجسيمات دون الذرية الموجودة في الذرة. بقاس العدد الكتلي (كتلة نواة الذرة) بواحدة الكتلة الذرية (amu).
مثال (1):
لدينا ذرة عددها الذري Z= 9، وعددها الكتلي 19A= فما هو عدد البروتونات، وعدد الإلكترونات، وعدد النيوترونات فيها؟
الحل:
نعلم أن عدد البروتونات = عدد الإلكترونات في الذرة المتعادلة، لذا يكون عدد البروتونات = 9 وهو يساوي أيضًا العدد الذري.
عدد النيوترونات = العدد الكتلي – العدد الذري = 19 – 9 = 10
لأن العدد الكتلي = (عدد البروتونات + عدد النيوترونات)، ونعلم أن عدد الإلكترونات = عدد البروتونات.
أيّ أنّ: (عدد البروتونات + عدد النيوترونات) – (عدد البروتونات = عدد الإلكترونات) = عدد النيوترونات.
مثال (2):
ما هو عدد النيوترونات في ذرة الكلور (Cl) التي عددها الذري Z= 17، وعددها الكتلي 35 A=
الحل:
بما أنّ العدد الذري يساوي عدد البروتونات، والعدد الكتلي = عدد البروتونات + عدد النيوترونات، فإن 35 = 17 + (عدد النيوترونات)، وبالتالي فإن عدد النيوترونات = 35 – 17= 18 نيوتروناً.
مثال (3):
ذرة الصوديوم، العدد الذري لها هو 11 Z=، ما هو عدد البروتونات؟ وما هو عدد الإلكترونات؟
الحل:
يُلحظ أنّ العدد الذري = عدد البروتونات = عدد الإلكترونات في الذرة المتعادلة، وبالتالي فإن عدد البروتونات يساوي 11، وبالتالي عدد الإلكترونات يساوي 11 أيضاً.
مثال (4):
ما هو عدد البروتونات، والنيوترونات، والإلكترونات في الذرة المتعادلة لعنصري البورون إذا علمت أن العدد الذري Z=5 والعدد الكتلي A=10، والزئبق (Hg19980)؟ العدد الذري Z=80 والعدد الكتلي A=119
الحل:
العدد الكتلي = (عدد البروتونات + عدد النيوترونات)
العدد الذري في ذرة البورون = 5، إذاً عدد البروتونات = 5، وعدد الإلكترونات = 5، وعدد النيوترونات = 5
العدد الذري في ذرة الزئبق = 80، إذاً عدد البروتونات = 80، وبالتالي عدد الإلكترونات = 80، وعدد النيوترونات = 119.
مثال (5):
جد العدد الذري لذرة تحتوي على 3 بروتونات، و 4 نيوترونات، و 3 إلكترونات.
الحل:
العدد الذري = عدد البروتونات = 3
مثال (6):
أوجد العدد الذري لذرة الباريومBa .
الحل:
بالعودة إلى الجدول الدوري، نجد أنّ موقع الباريوم في الصف السادس، وفي العمود الثاني، وترتيبه بين العناصر هو 56، إذاً العدد الذري للباريوم = 56.
مثال (7):
إذا كان عدد البروتونات لعنصر ما = 11، وعدد النيوترونات له = 12، جد العدد الذري، والعدد الكتلي لهذا العنصر.
الحل:
العدد الذري = عدد البروتونات = 11
العدد الكتلي = عدد البروتونات + عدد النيوترونات = 11 + 12 = 23
المصادر




















